Często zadawane pytania
Szczepionki autogenne są cennym dodatkiem do zestawu narzędzi lekarzy weterynarii. Szczepionki autogenne mogą być zmieniane wraz z ewoluującymi patogenami. Ta elastyczność szczepionki autogennej stanowi wartość dodaną, zwłaszcza gdy właściwości antygenowe patogenów zmieniają się w czasie. Szczepionki autogenne są pożądanym uzupełnieniem w zapobieganiu chorobom zakaźnym, promowania dobrostanu zwierząt i bezpieczeństwa żywności oraz zmniejszania presji infekcji, stosowania antybiotyków i oporności na środki przeciwdrobnoustrojowe.
Podstawę prawną stanowi art. 2 ust. 3 rozporządzenia (UE) 2019/6:
"[...] inaktywowane immunologiczne weterynaryjne produkty lecznicze, które są wytwarzane w oparciu o drobnoustroje patogenne i antygeny wyizolowane od zwierzęcia lub zwierząt należących do jednostki epidemiologicznej i są stosowane do leczenia tego zwierzęcia lub tych zwierząt w tej samej jednostce epidemiologicznej lub do leczenia jednego lub większej liczby zwierząt w stadzie o potwierdzonym powiązaniu epidemiologicznym".
Zgodnie z art. 4 nr 44 rozporządzenia (UE) 2019/6 i art. 4 nr 39 rozporządzenia (UE) 2016/429 jednostka epidemiologiczna to grupa zwierząt, w której prawdopodobieństwo narażenia na czynnik zakaźny jest równie wysokie.
Przy ustalaniu związku epidemiologicznego należy wziąć pod uwagę przemieszczanie się zwierząt między miejscami hodowli/gospodarstwami. W konsekwencji zwierzęta hodowane w miejscach hodowli/gospodarstwach różniących się geograficznie, które mają związek epidemiologiczny, należą do tej samej lokalizacji. Ma to zastosowanie głównie w przypadku drobiu lub świń, gdy bierze się pod uwagę linie rodzicielskie hodowane w systemach łańcucha produkcyjnego. W przypadku zwierząt wodnych powiązanie epidemiologiczne istnieje również między różnymi gospodarstwami/miejscami na jednym obszarze geograficznym, gdzie identyczny patogen krąży i rozprzestrzenia się np. przez dzikie gatunki wodne.
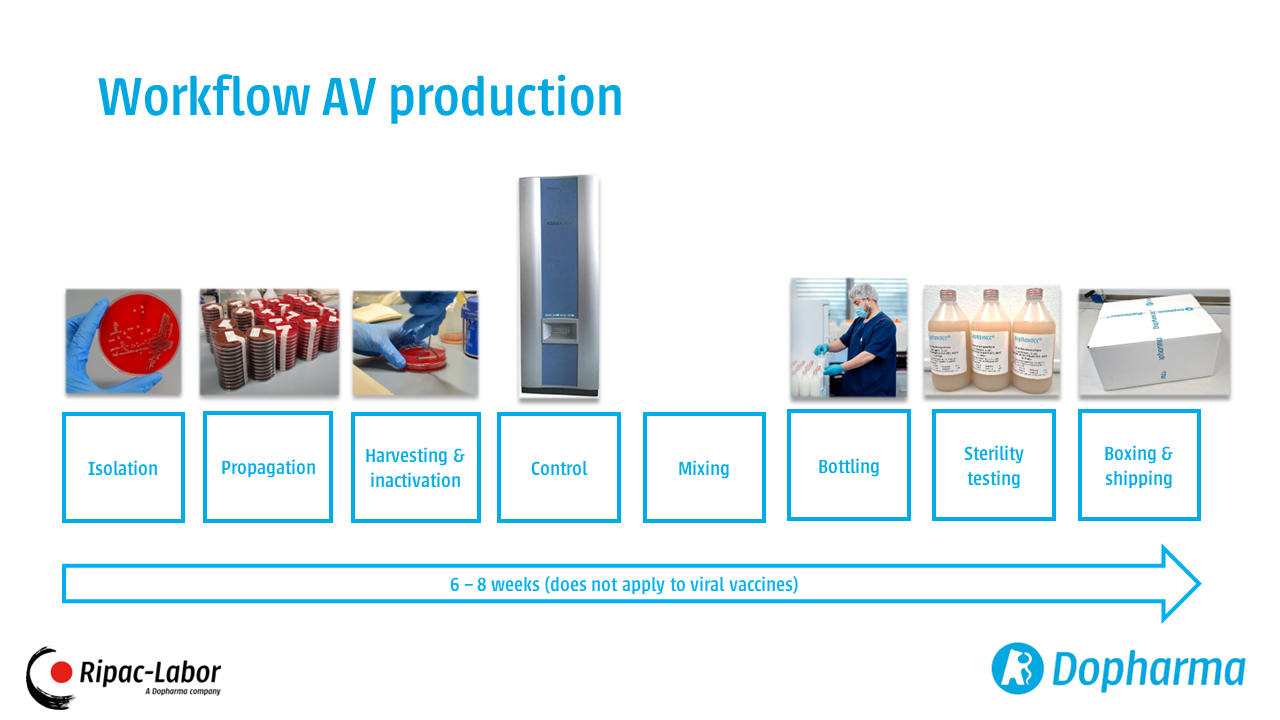
Zgodnie z Rozporządzeniem (UE) 2019/6 (Rozważanie 70, Art. 2(3) i Art. 94), autogenne immunologiczne leki weterynaryjne powinny być wytwarzane zgodnie z zasadami dobrej praktyki wytwarzania (GMP). W każdym razie nie ma jeszcze europejskich wytycznych GMP dotyczących produkcji autogennych szczepionek. Do czasu wydania odpowiednich wytycznych GMP dla szczepionek autogennych zgodnie z rozporządzeniem (UE) 2019/6, Ripac-Labor produkuje swoje szczepionki zgodnie z obowiązującymi przepisami niemieckimi i ukierunkowuje swoją produkcję i zapewnienie jakości na wymagania określone w "dokumencie z pytaniami i odpowiedziami" opublikowanym przez Centralne Biuro Krajów Związkowych ds. Ochrony Zdrowia w Lekach i Wyrobach Medycznych (ZLG Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten).
Produkcja Ripac-Labor zgodna z GMP jest weryfikowana przez regularne inspekcje przeprowadzane przez Państwowy Urząd Bezpieczeństwa Pracy, Ochrony Konsumentów i Zdrowia (LAVG). Ponadto Ripac-Labor wdrożył system zarządzania jakością w celu ciągłego sprawdzania i potwierdzania jakości wewnętrznych procesów i systemów poprzez samokontrole i kompleksowe środki kontroli jakości.
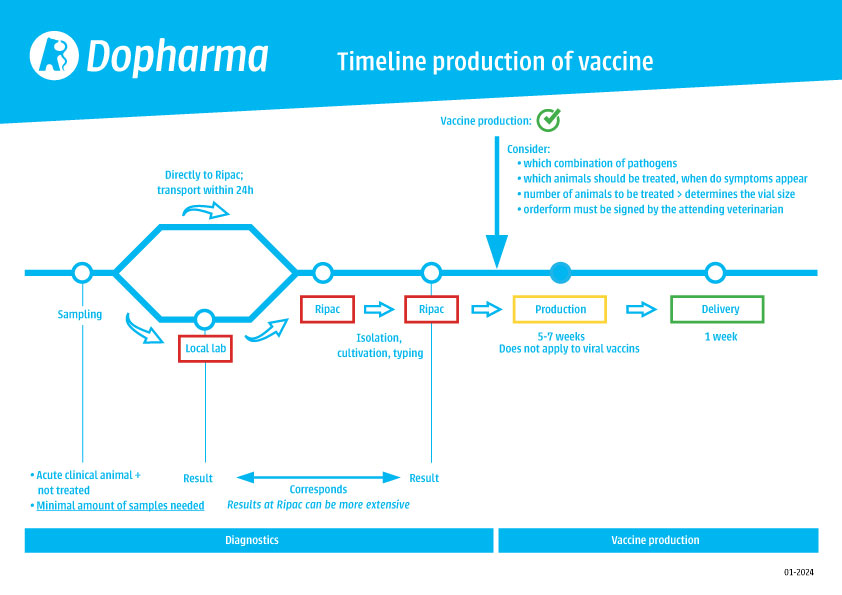
Ważne jest, aby pobierać próbki tylko od zwierząt wykazujących objawy ostrej choroby klinicznej. Zwierzęta te nie powinny być leczone środkami przeciwdrobnoustrojowymi przez co najmniej tydzień przed pobraniem próbek. W zależności od choroby wymagana jest określona liczba próbek. Prosimy o kontakt z lokalnym zespołem wsparcia technicznego w celu uzyskania porady.
Poproś lokalne laboratorium o przesłanie wymazu z podłożem transportowym czystej kultury do Ripac-Labor:
RIPAC-LABOR GmbH
Am Mühlenberg 11
D-14476 Poczdam-Golm
Niemcy
Telefon: +49 (0)331 5818400
Próbki do usług diagnostycznych można również wysyłać bezpośrednio do Ripac-Labor.
W stopce lub za pośrednictwem tego linku można uzyskać dostęp do strony gdzie pobierzesz wszystkie te dokumenty.
RIPAC-LABOR jest członkiem EMAV, stowarzyszenia europejskich producentów autogennych szczepionek i surowic. EMAV reprezentuje wiodących europejskich producentów autogennych szczepionek i surowic dla zwierząt hodowlanych, towarzyszących i egzotycznych. EMAV opublikowało podręcznik z wytycznymi dotyczącymi produkcji i stosowania szczepionek autogennych. Ta wyjątkowa publikacja została przygotowana przez uznanych naukowców z uniwersytetów weterynaryjnych w Europie, doświadczonych ekspertów weterynaryjnych i specjalistów z kręgu firm członkowskich EMAV.
Czy Twoje pytanie nie zostało jeszcze wspomniane? Skontaktuj się z nami.